|
 |
| J Korean Soc Cosmetol > Volume 28(3); 2022 > Article |
|
Abstract
Due to high therapeutic potentials of natural products, the use of medicinal plants is highlighted to treat the various inflammationmediated diseases. Myrrha have been used as a traditional remedy to treat infectious and inflammatory diseases. But, its effects and mechanisms of anti atopic dermatitis (AD) have not been elucidated. The aim of this study is to evaluate anti-allergic and antiinflammatory effects of the water extract of Myrrha, in cell models and also to suggest a putative mechanism of AD actions of Myrrha. HaCaT cells were pre-treated with Myrrha for 1 h and stimulated with tumor necrosis factor-alpha (TNF-╬▒) and interferon-gamma (IFN-╬│) (10 ng/mL each). After 24 h, cells were harvested To evaluate the expression of Th2 chemokines, such as C-C motif chemokine ligand 5 (CCL5, also known as RANTES), C-C chemokine ligand 17 (CCL17, also known as TARC) and C-C chemokine ligand 22 (CCL22, also known as MDC). To investigate the regulatory mechanisms of Myrrha, we also assessed the phosphorylation of signal transducer and activator of transcription 1 (STAT1) signaling pathways in HaCaT cells. Treatment of Myrrha decreased the mRNA levels of RANTES, TARC and MDC with a concentration dependent manner. In addition, Myrrha significantly reduced TNF-╬▒ and IFN-╬│ induced phosphorylation of STAT1. This could indicate that the Myrrha shows anti AD activity mainly through STAT1. Thus, we propose that Myrrha may be a promising anti AD skin protector, which could suggest the clinical basis for cosmetics development.
ņĢīļĀłļź┤ĻĖ░(allergy)ļ×Ć ņÖĖļČĆļ¼╝ņ¦łņØĖ ĒĢŁņøÉ(allergen)Ļ│╝ņØś ņĀæņ┤ēņŚÉ ņØśĒĢśņŚ¼ Ļ│╝ļ»╝ļ░śņØæņØ┤ ļéśĒāĆļéśļŖö ņäĀņ▓£ņĀü ļśÉļŖö Ēøäņ▓£ņĀü ļ®┤ņŚŁņ¦łĒÖśņ£╝ļĪ£ņä£ ņĢīļĀłļź┤ĻĖ░ņä▒ ļ╣äņŚ╝(allergic rhinitis), ņĢäĒåĀĒö╝ Ēö╝ļČĆņŚ╝(atopic Dermatitis), ņ▓£ņŗØ(asthma) ļō▒ņØ┤ ļīĆĒæ£ņĀüņØĖ ņĢīļĀłļź┤ĻĖ░ ņ¦łĒÖśņŚÉ ĒĢ┤ļŗ╣ĒĢ£ļŗż(Lee, 2010). Ēö╝ļČĆļŖö ņÖĖļČĆĒÖśĻ▓Įņ£╝ļĪ£ļČĆĒä░ ļ│┤ĒśĖņןļ▓ĮņØś ņŚŁĒĢĀņØä ņłśĒ¢ēĒĢśļ®┤ņä£ ņłś ļ¦ÄņØĆ ĒĢŁņøÉņŚÉ ņĀæņ┤ēĒĢśļŖöļŹ░ ņĢäĒåĀĒö╝ Ēö╝ļČĆņŚ╝ņØĆ ņÖĖļČĆ ĒĢŁņøÉĻ│╝ņØś ņĀæņ┤ēņŚÉ ņØśĒĢśņŚ¼ Ļ│╝ļ»╝ĒĢśĻ▓ī ļ░śņØæĒĢśļŖö ļ®┤ņŚŁņØ┤ņāüļ░śņØæņ£╝ļĪ£ Ēö╝ļČĆņŚÉ ļ¦īņä▒ņĀüņ£╝ļĪ£ ņ×¼ļ░£ĒĢśļŖö ņŚ╝ņ”Øņä▒ ņ¦łĒÖśņØ┤ļŗż(Leung et al., 2004; Park & Park, 2007). ņŻ╝ļĪ£ ņśü ņ£ĀņĢäĻĖ░ņŚÉ ĒØöĒ׳ ļ░£ņāØĒĢśņ¦Ćļ¦ī ņä▒ņØĖĻ╣īņ¦ĆļÅä ņ¦ĆņåŹļÉśĻ▒░ļéś, ņä▒ņØĖņØ┤ ļÉśņ¢┤ ņāłļĪŁĻ▓ī ļ░£ļ│æĒĢĀ ņłś ņ׳ņ£╝ļ®░ ņĀÉņ░© ņ£Āļ│æļźĀņØ┤ ņ”ØĻ░ĆĒĢśĻ│Ā ņ׳ļŖö ņČöņäĖņØ┤ļŗż(Lee et al., 2012). ņĢäĒåĀĒö╝ Ēö╝ļČĆņŚ╝ņØĆ ĒÖśĻ▓ĮņĀü, ņ£ĀņĀäņĀü ņÜöņØĖĻ│╝ ļ®┤ņŚŁņĪ░ņĀł ļČłĻĘĀĒśĢ, Ēö╝ļČĆņןļ▓Į ņØ┤ņāü ļō▒ņØś ļŗżņ¢æĒĢ£ ņøÉņØĖņŚÉ ņØśĒĢśņŚ¼ ļ░£ļ│æļÉ£ļŗż(Larsen & Hanifin, 2002; Searing & Leung, 2010). Ēśäņ×¼ ņĢäĒåĀĒö╝ Ēö╝ļČĆņŚ╝ņØś ņ”Øņāü ņÖäĒÖöļź╝ ņ£äĒĢśņŚ¼ ĒÖśĻ▓ĮĻ░£ņäĀ, ņŖżĒģīļĪ£ņØ┤ļō£ ņÖĖņÜ®ņĀ£ ņ▓śļ░®, ļ│┤ņŖĄņĀ£, ĒĢŁĒ׳ņŖżĒāĆļ»╝ņĀ£, ĒĢŁņāØņĀ£ ļō▒ņØś ļ░®ļ▓ĢņØ┤ ņé¼ņÜ®ļÉśĻ│Ā ņ׳ņ£╝ļéś ĒĢŁĒ׳ņŖżĒāĆļ»╝ņĀ£ ļ░Å ņŖżĒģīļĪ£ņØ┤ļō£ļź╝ ņןĻĖ░Ļ░ä ņé¼ņÜ®ĒĢĀ Ļ▓ĮņÜ░ ļé┤ņä▒ ļ░Å ļČĆņ×æņÜ®ņØä ņØ╝ņ£╝Ēé¼ ņłś ņ׳ņ£╝ļ»ĆļĪ£ ņ¦ĆņåŹņĀüņØĖ ņé¼ņÜ®ņØĆ ņĀ£ĒĢ£ļÉ£ļŗż(Yang et al., 2010). ļö░ļØ╝ņä£ ļ░£ļ│æĒÖśņ×ÉņØś ņéČņØś ņ¦łņØä ļ¢©ņ¢┤ļ£©ļ”¼Ļ│Ā, ĻĘ╝ļ│ĖņĀüņØĖ ņ╣śļŻī ļ░®ļ▓ĢņØ┤ ņŚåļŖö ņĢäĒåĀĒö╝ Ēö╝ļČĆņŚ╝ņØś ņ”Øņāü ņÖäĒÖöļź╝ ņ£äĒĢ┤ņä£ļŖö ļČĆņ×æņÜ®ņØ┤ ņĄ£ņåīĒÖöļÉśĻ│Ā ņןĻĖ░Ļ░ä ņé¼ņÜ®ĒĢĀ ņłś ņ׳ļŖö ņ▓£ņŚ░ļ¼╝Ļ│╝ Ļ░ÖņØĆ ļīĆņ▓┤ ņ×ÉņøÉņØä ĒāÉņāēĒĢśĻ│Ā Ļ░£ļ░£ĒĢśļŖö Ļ▓āņØ┤ ņŗ£ĻĖēĒĢ£ Ļ▓āņ£╝ļĪ£ ĒīÉļŗ©ļÉ£ļŗż(Arellano et al., 2007; Yu et al., 2018). Ēö╝ļČĆ Ļ░üņ¦łĒśĢņä▒ņäĖĒżļŖö Ēæ£Ēö╝ļź╝ ĻĄ¼ņä▒ĒĢśļŖö ņŻ╝ņÜö ņäĖĒżļĪ£ņä£ Ēö╝ļČĆņØś ņāØĒÖöĒĢÖņĀü┬Ęļ¼╝ļ”¼ņĀü ņāüĒā£ļź╝ ņ£Āņ¦ĆĒĢśļ®░, ļŗżņ¢æĒĢ£ ņŚ╝ņ”Øņä▒ Ēö╝ļČĆ ņ¦łĒÖśņØś ņ¦äĒ¢ēĻ│╝ ļ░£ļŗ¼ņŚÉ Ļ┤ĆņŚ¼ĒĢ£ļŗż. Ēæ£Ēö╝ Ļ░üņ¦łĒśĢņä▒ņäĖĒżļŖö ņ×ÉņÖĖņäĀ, ĒĢŁņøÉ ļ░Å ĒÖöĒĢÖ ļ¼╝ņ¦łņØä ĒżĒĢ©ĒĢ£ ļ®┤ņŚŁ ņ£Āļ░£ ņÜöņØĖņŚÉ ļ░śņØæĒĢśņŚ¼ ņĀäņŚ╝ņ”Øņä▒ ņé¼ņØ┤ĒåĀņ╣┤ņØĖ ļ░Å ņ╝Ćļ¬©ņ╣┤ņØĖĻ│╝ Ļ░ÖņØĆ ņŚ╝ņ”Ø ļ¦żĻ░£ņ▓┤ļź╝ ļ░®ņČ£ĒĢ£ļŗż(Werfel, 2009). ĒÖ£ņä▒ĒÖöļÉ£ Ļ░üņ¦łĒśĢņä▒ņäĖĒżļŖö ņØĖĒä░ļŻ©Ēé©(IL)-8 ļ░Å IL-6ņØä ņāØņä▒ĒĢĀ ņłś ņ׳ņ£╝ļ®░, ņØ┤ļŖö T ņäĖĒż ļ░Å ĒśĖņżæĻĄ¼Ļ░Ć Ēæ£Ēö╝ļĪ£ ņ£Āņ×ģļÉśļŖö Ļ▓āņØä ļ¦żĻ░£ĒĢ£ļŗż. ļśÉĒĢ£ Ļ░üņ¦łĒśĢņä▒ņäĖĒżņŚÉņä£ ļČäļ╣äļÉśļŖö ĒØēņäĀ ļ░Å ĒÖ£ņä▒ĒÖö ņĪ░ņĀł ņ╝Ćļ¬©ņ╣┤ņØĖ(Thymus & activation-regulated chemokine, TARC/CCL17), ļīĆņŗØņäĖĒż ņ£ĀļÅä ņ╝Ćļ¬©ņ╣┤ņØĖ(macrophage-derived chemokine, MDC/CCL22) ļ░Å ņĪ░ņĀłļÉ£ ņĀĢņāü T ņäĖĒż ļ░£Ēśä ļ░Å ļČäļ╣ä(regulated on activation normal T-cell expression and secreted, RANTES/CCL5)ļŖö Th2 ņäĖĒżĻ░Ć ņŚ╝ņ”Ø ņĪ░ņ¦üņ£╝ļĪ£ ņ╣©Ēł¼ĒĢśļŖö ļŹ░ ņżæņÜöĒĢ£ ņŚŁĒĢĀņØä ĒĢ£ļŗż(Jeong et al., 2010; Lee et al., 2008; Pham et al., 2017; Tanaka et al., 2006; Yang et al., 2015).
ļ│Ė ņŚ░ĻĄ¼ņŚÉ ņé¼ņÜ®ĒĢ£ ļ¬░ņĢĮ(Myrrha)ņØĆ Commiphora molmol Engler ļ░Å ļÅÖņåŹņŗØļ¼╝(Ļ░Éļ×īļéśļ¼┤Ļ│╝ Burseraceae)ņŚÉņä£ ņ¢╗ļŖö Ļ│Āļ¼┤ ņłśņ¦ĆņØ┤ļ®░, ņĢäĒöäļ”¼ņ╣┤, ņĢäļØ╝ļ╣äņĢä, ļ¦łļŗżĻ░ĆņŖżņ╣┤ļź┤ ļ░Å ņØĖļÅäņŚÉ ņä£ņŗØĒĢśļ®░ 200 ņóģ ņØ┤ņāüņ£╝ļĪ£ ĻĄ¼ņä▒ļÉśņ¢┤ ņ׳ļŗż(Hanus et al., 2005). ņĢäļ׏ņ¢┤ļĪ£ Murr ļØ╝ļŖö ļŗ©ņ¢┤ļŖö ŌĆ£ņō┤ ļ¦øŌĆØņØä ņØśļ»ĖĒĢśļ®░, ļ¬░ņĢĮņØĆ ņō░Ļ│Ā ļ¦żņÜ░ļ®░ ņä▒ņ¦łņØĆ ļö░ļ£╗ĒĢśĻ│Ā ļÅģņØ┤ ņŚåļŗż. ļ¬░ņĢĮņØĆ ņłśņÜ®ņä▒ Ļ│Āļ¼┤ņ¦ł(gum), ņĢīņĮöņś¼ ņłśņÜ®ņä▒ ņłśņ¦Ć ļ░Å Ē£śļ░£ņä▒ ņśżņØ╝ļĪ£ ĻĄ¼ņä▒ļÉ£ļŗż. Ļ│Āļ¼┤ņ¦łņØĆ ļŗżļŗ╣ļźśņÖĆ ļŗ©ļ░▒ņ¦łņØä ĒĢ©ņ£ĀĒĢśĻ│Ā ņ׳ļŖö ļ░śļ®┤, Ē£śļ░£ņä▒ ņśżņØ╝ņØĆ ņŖżĒģīļĪ£ņØ┤ļō£(steroids), ņŖżĒģīļĪż(sterols), Ēģīļź┤ĒÄ£(terpenes)ņ£╝ļĪ£ ĻĄ¼ņä▒ļÉśņ¢┤ ņ׳ļŗż. ļ¬░ņĢĮņØś ĒŖ╣ņ¦ĢņĀüņØĖ ļāäņāłļŖö ĒæĖļØ╝ļģĖņŖżĒĆ┤Ēģīļź┤ĒÄ£(furanosesquiterpenes)ņŚÉņä£ ņ£ĀļלĒĢ£ļŗż. ļ¬░ņĢĮņØĆ ņłśņäĖĻĖ░ ļÅÖņĢł Ē¢źĻ│╝ Ē¢źņłśļĪ£ ņé¼ņÜ®ļÉśņŚłņ£╝ļéś ņĄ£ĻĘ╝ņŚÉļŖö Ļ│Āļ¼┤ņ¦łņØś ņåīļÅģņĀ£ļĪ£ņä£ ņØśĒĢÖņĀü ņÜ®ļÅäļź╝ ļ░£Ļ▓¼Ē¢łņ£╝ļ®░, ĒīģĒü¼(tincture)ļŖö ņØĖĒøä ļ░Å ĻĄ¼Ļ░ĢņØś ņŚ╝ņ”Ø ļ░Å ĻČżņ¢æ ņāüĒā£ņŚÉ ņĢĮņÜ®ņ£╝ļĪ£ ņé¼ņÜ®ĒĢ£ļŗż(Hough et al., 1952). ļśÉĒĢ£, ļ¬░ņĢĮņØĆ ņāüņ▓śļź╝ ņ╣śļŻīĒĢśĻ│Ā, ļČĆņóģņØä ņÖäĒÖöĒĢśĻ│Ā, ĒśłņĢĪ ņĀĢņ▓┤ļĪ£ ņØĖĒĢ£ ņāØļ”¼ĒåĄņØä ņ╣śļŻīĒĢśĻĖ░ ņ£äĒĢśņŚ¼ ņżæĻĄŁņØśĒĢÖņŚÉņä£ ņé¼ņÜ®ļÉśņŚłņ£╝ļ®░, ņĢäņ£Āļź┤ļ▓Āļŗż ņØśĒĢÖņŚÉņä£ļÅä ņśżļ×½ļÅÖņĢł ņé¼ņÜ®ļÉśņ¢┤ņÖöļŗż(Hanus et al., 2005). ļ¬░ņĢĮņØś ĒÜ©ļŖźņŚÉ ļīĆĒĢ£ ļģ╝ļ¼Ėņ£╝ļĪ£ļŖö ņ×ÉĻČüĻ▓ĮļČĆņĢöņäĖĒżņØś ņäĖĒżņ×Éņé┤(apoptosis) ņ£ĀļÅä ĒÜ©Ļ│╝(Park et al., 2006), ņŗØņżæļÅģ ļ»ĖņāØļ¼╝ ņ”ØņŗØ ņ¢ĄņĀ£ĒÜ©Ļ│╝ņÖĆ ņé┤ĻĘĀĒÜ©Ļ│╝(Han et al., 2001), ĒÖöņāüņŚÉ ļīĆĒĢ£ Ēö╝ļČĆņ×¼ņāØ ļ░Å ņ╣śņ£Ā ĒÜ©Ļ│╝(Nam et al., 2003), ņĢĮņ╣©ņŚÉņØśĒĢ£ ņ¦äĒåĄ ĒÜ©Ļ│╝(Ahn et al., 1994), ļ¬░ņĢĮ ļō▒ņØś ņČöņČ£ļ¼╝ņØ┤ ĒĢ©ņ£ĀļÉ£ ņ╣śņĢĮņØś ņåīņŚ╝ ĒÜ©Ļ│╝(Gang et al., 1991)ņÖĆ ĒĢŁņŚ╝ņ”Ø ĒÜ©Ļ│╝ ļ░Å ĒÖöņןĒÆł ņĢĮļ”¼ĒÖ£ņä▒(Jang et al., 2009)ņŚÉ ļīĆĒĢśņŚ¼ ļ│┤Ļ│ĀļÉśņŚłļŗż. ļŗżņ¢æĒĢ£ ņŚ╝ņ”Ø ņ¦łĒÖśņŚÉņä£ņØś ļ¬░ņĢĮņØś ĒÜ©Ļ│╝Ļ░Ć ļ│┤Ļ│ĀļÉśĻ│Ā ņ׳ņ£╝ļéś, ņĢīļĀłļź┤ĻĖ░ ļ░śņØæņ£╝ļĪ£ ņØĖĒĢ£ Ēö╝ļČĆ ņŚ╝ņ”Øņ¢ĄņĀ£ ĒÜ©Ļ│╝ņŚÉ Ļ┤ĆĒĢ£ ņŚ░ĻĄ¼ļŖö ļ»Ėļ╣äĒĢ£ ņŗżņĀĢņØ┤ļŗż. ļö░ļØ╝ņä£ ļ│Ė ņŚ░ĻĄ¼ņŚÉņä£ļŖö ļ¬░ņĢĮņØś ņĢīļĀłļź┤ĻĖ░ņä▒ Ēö╝ļČĆņŚ╝ņ”ØņŚÉ ļīĆĒĢ£ ĒĢŁņŚ╝ņ”Ø ĒÜ©Ļ│╝ļź╝ ņäżļ¬ģĒĢśĻĖ░ ņ£äĒĢśņŚ¼ ņé¼ļ×ī Ļ░üņ¦łĒśĢņä▒ņäĖĒżņŻ╝ņØĖ HaCaT(Human Adult low Calcium High Temperature) ņäĖĒżņŚÉ ņóģņ¢æ Ļ┤┤ņé¼ ņØĖņ×É-╬▒(Tumor Necrosis Factor-Alpha, TNF-╬▒) ļ░Å ņØĖĒä░ĒÄśļĪĀ-╬│(Interferon-gamma, IFN-╬│)ļź╝ ņ▓śļ”¼ĒĢśņŚ¼ ņĢīļĀłļź┤ĻĖ░ ļ░śņØæņØä ņ£ĀļÅäĒĢśņśĆĻ│Ā, ļ¬░ņĢĮ ļ¼╝ ņČöņČ£ļ¼╝ņØä ņØ┤ņÜ®ĒĢśņŚ¼ Ēö╝ļČĆ ņĢīļĀłļź┤ĻĖ░ ļ░śņØæņŚÉ ņ׳ņ¢┤ ņżæņÜöĒĢ£ Ēæ£ņĀüļ¼╝ņ¦łļĪ£ ņĢīļĀżņ¦ä TARC/CCL17, MDC/CCL22 ļ░Å RANTES/CCL5ņÖĆ Ļ░ÖņØĆ ņ╝Ćļ¬©ņ╣┤ņØĖņØś ĒÖ£ņä▒ņŚÉ ļ¬░ņĢĮņØ┤ ļ»Ėņ╣śļŖö ņśüĒ¢źĻ│╝ ĻĘĖ ĻĖ░ņĀäņŚÉ ļīĆĒĢśņŚ¼ ņĪ░ņé¼ĒĢśņśĆļŗż.
ļ│Ė ļģ╝ļ¼ĖņŚÉ ņé¼ņÜ®ĒĢ£ ļ¬░ņĢĮ ņČöņČ£ļ¼╝ņØĆ Ļ┤æļ¬ģļŗ╣ ņĀ£ņĢĮ(ņÜĖņé░, ļīĆĒĢ£ļ»╝ĻĄŁ)ņŚÉņä£ ĻĄ¼ņ×ģĒĢśņŚ¼ ņĀĢņäĀĒĢ£ Ēøä ņé¼ņÜ®ĒĢśņśĆļŗż. ļ¬░ņĢĮ ņČöņČ£ļ¼╝ņØĆ ļ¬░ņĢĮ 100 gņŚÉ ņ”Øļźśņłś 1 Lļź╝ ņØ┤ņÜ®ĒĢśņŚ¼ 100┬░CņŚÉņä£ 150ļČä ļÅÖņĢł ņŚ┤ņłś ņČöņČ£ĒĢ£ Ēøä -80┬░CņŚÉņä£ ĒĢśļŻ©ļÅÖņĢł ļÅÖĻ▓░ĒĢśņśĆņ£╝ļ®░, ļÅÖĻ▓░ļÉ£ ļ¬░ņĢĮ ņČöņČ£ļ¼╝ņØä ļÅÖĻ▓░ Ļ▒┤ņĪ░ĻĖ░(IlShinBioBase, Dongducheon, Korea)ļź╝ ņØ┤ņÜ®ĒĢśņŚ¼ -50┬░CņŚÉņä£ 4mTorr ņĢĢļĀźņ£╝ļĪ£ 7ņØ╝ ļÅÖņĢł ļÅÖĻ▓░ Ļ▒┤ņĪ░ĒĢśņśĆļŗż. ļÅÖĻ▓░ Ļ▒┤ņĪ░ļÉ£ ļ¬░ņĢĮ ņČöņČ£ļ¼╝ ĒīīņÜ░ļŹöļŖö 0.22 ╬╝m filterļź╝ ņØ┤ņÜ®ĒĢśņŚ¼ ņŚ¼Ļ│╝ĒĢśņŚ¼ ņé¼ņÜ®ĒĢśņśĆļŗż. ļÅÖĻ▓░ Ļ▒┤ņĪ░ Ēøä ņłśļōØĒĢ£ ļČäļ¦ÉņØĆ 21.37 gņ£╝ļĪ£ ņłśņ£©ņØĆ 21.37%ņśĆļŗż. ļ¬░ņĢĮ ņżĆļ╣äĻ│╝ņĀĢņØĆ Table 1ņŚÉ ļéśĒāĆļé┤ņŚłļŗż.
ņØĖņ▓┤ ņ£ĀļלĒö╝ļČĆ keratinocyteņØĖ Ļ░üņ¦łĒśĢņä▒ņäĖĒż HaCaT (Human Adult low Calcium High Temperature) ņäĖĒżņŻ╝ļź╝ RPMI 1640 mediumņŚÉ 10% FBSņÖĆ 1% Penicillin ņ▓©Ļ░Ć Ēøä 37┬░C, 5% CO2ņØś ņĪ░Ļ▒┤ņŚÉņä£ ļ░░ņ¢æĒĢśņśĆļŗż. Ļ│äļīĆļ░░ņ¢æņØĆ 2~3ņØ╝ Ļ░äĻ▓®ņ£╝ļĪ£ ĒĢśļ®░ ņ£Āņ¦ĆĒĢśņśĆļŗż.
HaCaT ņäĖĒżņŚÉņä£ ļ¬░ņĢĮņØś ņäĖĒż ļÅģņä▒ ĒÅēĻ░Ćļź╝ ņ£äĒĢśņŚ¼ MTT ļČäņäØ ļ░®ļ▓ĢņØä ņØ┤ņÜ®ĒĢśņśĆļŗż. RPMI 1640 ļ░░ņ¦ĆņŚÉ HaCaT ņäĖĒżļź╝ 24well plateņŚÉ 1├Ś105 cells/mL 500 ╬╝L/wellļĪ£ ļČäņŻ╝ĒĢśņŚ¼ 37┬░C, 5% CO2 ņĪ░Ļ▒┤ņŚÉņä£ 3ņŗ£Ļ░ä ļÅÖņĢł ņĢłņĀĢĒÖö ĒĢśņśĆļŗż. ĻĘĖ Ēøä, Ļ░ü wellņŚÉ ļ¬░ ņĢĮ ņČöņČ£ļ¼╝ņØä 0.01, 0.05, 0.1, 0.25, 0.5, 0.75, 1, 2, 5, 10 ļ░Å 50 mg/mLņØś ļåŹļÅäļĪ£ ņ▓śļ”¼ĒĢśņŚ¼ 24ņŗ£Ļ░ä ļÅÖņĢł ņØĖĒüÉļ▓ĀņØ┤Ēä░ņŚÉņä£ ļ░░ņ¢æĒĢśņśĆļŗż. ļ░░ņ¢æ Ēøä Ļ░ü wellņŚÉ 5 mg/mL ļåŹļÅäņØś MTT ņÜ®ņĢĪņØä Ļ░ĆĒĢ£ ļÆż 5% CO2 ņĪ░Ļ▒┤ņŚÉņä£ 37┬░CļĪ£ 30ļČäĻ░ä ļ░░ņ¢æĒĢśņśĆļŗż. ĻĘĖ Ēøä, ņāüļō▒ņĢĪņØä ņĀ£Ļ▒░ĒĢśĻ│Ā, DMSO 200 ╬╝Lļź╝ ļäŻņ¢┤ formazan Ļ▓░ņĀĢņ▓┤ļź╝ ņÜ®ĒĢ┤ņŗ£ņ╝£ 96 well plateņŚÉ 90 ╬╝L/wellņö® ļČäņŻ╝ĒĢśņŚ¼ Spectrometer(Molecular Devices, San jose, CA, USA)ļĪ£ 540 nm ĒīīņןņŚÉņä£ ĒØĪĻ┤æļÅäļź╝ ņĖĪņĀĢĒĢśņśĆļŗż.
HaCaT ņäĖĒżļź╝ 6 well plateņŚÉ 5├Ś105 cells/mLļĪ£ 2 mL/wellļĪ£ ļČäņŻ╝ĒĢśņŚ¼ 37┬░C, 5% CO2 ņĪ░Ļ▒┤ņŚÉņä£ 3ņŗ£Ļ░ä ļÅÖņĢł ņĢłņĀĢĒÖö ĒĢśņśĆļŗż. ĻĘĖ Ēøä, ļ¬░ņĢĮ ņČöņČ£ļ¼╝ņØä 0.1, 0.5 ļ░Å 1 mg/mL ļåŹļÅäļĪ£ 1ņŗ£Ļ░ä ļÅÖņĢł ņĀä ņ▓śļ”¼ĒĢśņśĆļŗż. ĻĘĖ Ēøä, TNF-╬▒ (10 ng/mL) ļ░Å IFN-╬│ (10 ng/mL)ļź╝ ņ▓śļ”¼ĒĢśņŚ¼ ņäĖĒżļź╝ 24ņŗ£Ļ░ä ļÅÖņĢł ņ×ÉĻĘ╣ĒĢśņśĆņ£╝ļ®░, Cold PBSļĪ£ 2ĒÜī ņäĖņ▓ÖĒĢśņŚ¼ ņäĖĒżļ¦ī ļé©ĻĖ┤ Ēøä, Ļ░ü wellļŗ╣ 1 mLņØś Easy-BLUE ņÜ®ņĢĪņØä ļäŻņ¢┤ ņäĖĒżļ¦ēņØä ņÜ®ĒĢ┤ņŗ£Ēé© Ēøä Total RNAļź╝ ņČöņČ£ĒĢśņśĆļŗż(Jo & Choi, 2021). 1 ╬╝gņØś RNAļź╝ Rever Tra Ace qPCR RT Kitļź╝ ņé¼ņÜ®ĒĢśņŚ¼ cDNAļź╝ ĒĢ®ņä▒ĒĢśņśĆņ£╝ļ®░, SYBR Green Master MixņÖĆ StepOneTM RealTime PCR system (Applied Biosystem)ņØä ņé¼ņÜ®ĒĢśņŚ¼ Realtime reverse transcription-polymerase chain reaction(realtime RT-PCR)ņØä ņłśĒ¢ēĒĢśņśĆņ£╝ļ®░, Housekeeping ņ£ĀņĀäņ×Éļź╝ ņØ┤ņÜ®ĒĢśņŚ¼ RNA ņ¢æņØä ļ│┤ņĀĢĒĢśņśĆļŗż. Ēæ£ņĀü ņ£ĀņĀäņ×ÉļŖö ĒŖ╣ņØ┤ņĀüņØĖ Primerļź╝ ņŻ╝ļ¼ĖņĀ£ņ×æĒĢśņŚ¼ ņé¼ņÜ®ĒĢśņśĆņ£╝ļ®░, Ļ░ü PrimerņØś ņŚ╝ĻĖ░ņä£ņŚ┤ņØĆ Table 3ņŚÉ ļéśĒāĆļé┤ņŚłļŗż.
HaCaT ņäĖĒżļź╝ 6 cm dishņŚÉ 25├Ś105 cells/mLļĪ£ ļČäņŻ╝ĒĢśņŚ¼ 37┬░C, 5% CO2 ņĪ░Ļ▒┤ņŚÉņä£ 3ņŗ£Ļ░ä ļÅÖņĢł ņĢłņĀĢĒÖö ĒĢśņśĆļŗż. ĻĘĖ Ēøä, ļ¬░ņĢĮ ņČöņČ£ļ¼╝ņØä 0.1, 0.5 ļ░Å 1 mg/mL ļåŹļÅäļĪ£ 1ņŗ£Ļ░ä ņĀäņ▓śļ”¼ĒĢśĻ│Ā TNF-╬▒ (10 ng/mL) ļ░Å IFN-╬│ (10 ng/mL)ļĪ£ ņäĖĒżļź╝ 15ļČä ļÅÖņĢł ņ×ÉĻĘ╣ĒĢśņśĆļŗż. ĻĘĖļ”¼Ļ│Ā, Cold PBSļĪ£ 2ĒÜī ņäĖņ▓ÖĒĢśņŚ¼ ņäĖĒżļ¦ī ļé©ĻĖ┤ Ēøä, RIPA lysis buffe (1X RIPA buffer + Protease inhibitor, Phosphatase inhibitor)ļź╝ ļäŻņØĆ ļÆż ņäĖĒżļź╝ harvest ĒĢśņśĆļŗż. ņäĖĒż ļŗ©ļ░▒ņ¦ł ņČöņČ£ņØä ņ£äĒĢśņŚ¼ 4┬░CņŚÉņä£ 2ņŗ£Ļ░ä ļÅÖņĢł Lysis ĒĢśĻ│Ā, ņøÉņŗ¼ļČäļ”¼ĒĢśņŚ¼ ņāüņĖĄņĢĪņØä ņØ┤ņÜ®ĒĢśņŚ¼ Bradfordļ▓Ģņ£╝ļĪ£ ļŗ©ļ░▒ņ¦łņØä ņĀĢļ¤ēĒĢśņśĆļŗż. ļÅÖļ¤ēņØś ļŗ©ļ░▒ņ¦łņŚÉ Sample bufferļź╝ ļäŻņØĆ ļÆż 98┬░C Heating blockņŚÉņä£ 5ļČäĻ░ä ļüōņØĖ ļŗżņØī ļ│┤Ļ┤ĆĒĢśņśĆļŗż. ļŗ©ļ░▒ņ¦ł ņāśĒöīņØä 8% SDS PAGEņŚÉ ņĀäĻĖ░ ņśüļÅÖĒĢ£ Ēøä Membraneņ£╝ļĪ£ ņś«Ļ▓© 5% Skim milkĻ░Ć ĒĢ©ņ£ĀļÉ£ PBST (PBS-Tween 20) ņÜ®ņĢĪņ£╝ļĪ£ ņāüņś©ņŚÉņä£ 2ņŗ£Ļ░ä ļÅÖņĢł Blocking ĒĢśņśĆļŗż. phospho-STAT1 ļ░Å STAT1 ļČäņäØņØä ņ£äĒĢśņŚ¼ 1, 2ņ░© ĒĢŁņ▓┤ļź╝ ļ░śņØæņŗ£ņ╝░ļŗż. ĻĘĖļ”¼Ļ│Ā ECL detection ņÜ®ņĢĪņØś ļ░śņØæņØä ņØ┤ņÜ®ĒĢśņŚ¼ Chemidoc (Bio-rad, Hercules, CA, USA) ĻĖ░ĻĖ░ļĪ£ ļŗ©ļ░▒ņ¦ł ļ░£Ēśä ņĀĢļÅäļź╝ ĒÖĢņØĖĒĢśņśĆļŗż.
ņé¼ļ×ī Ēö╝ļČĆ Ļ░üņ¦łĒśĢņä▒ņäĖĒżņŚÉņä£ ļ¬░ņĢĮņØś ņäĖĒżļÅģņä▒ ĒÅēĻ░Ćļź╝ ņ£äĒĢśņŚ¼ MTT assayļź╝ ņłśĒ¢ēĒĢśņśĆļŗż. ļ¬░ņĢĮņØä 0.01, 0.05, 0.1, 0.25, 0.5, 0.75, 1, 2, 5, 10 ļ░Å 50 mg/mLņØś ļåŹļÅäļĪ£ ņ▓śļ”¼ĒĢśņŚ¼ 24ņŗ£Ļ░ä ļÅÖņĢł ļ░░ņ¢æ Ēøä, ņäĖĒż ņāØņĪ┤ņ£©ņØä Ļ┤Ćņ░░ĒĢśņśĆļŗż. ĻĘĖ Ļ▓░Ļ│╝, ļ¬░ņĢĮ 2, 5, 10, 50 mg/mLņŚÉņä£ ņ£ĀņØśņä▒ ņ׳ļŖö ņäĖĒż ļÅģņä▒ņØ┤ Ļ┤Ćņ░░ļÉśņŚłĻ│Ā, 0.01, 0.05, 0.1, 0.25, 0.5 0.75 ļ░Å 1 mg/mL ļåŹļÅäņŚÉņä£ļŖö ņ£ĀņØśņä▒ ņ׳ļŖö ņäĖĒż ļÅģņä▒ņØĆ Ļ┤Ćņ░░ļÉśņ¦Ć ņĢŖņĢśļŗż(Fig. 1). ļö░ļØ╝ņä£ ņØ┤Ēøä ņŗżĒŚśņØĆ ļÅģņä▒ņØ┤ ņŚåļŖö ņāüĻĖ░ ļåŹļÅä ļ▓öņ£äņŚÉņä£ ņłśĒ¢ēĒĢśņśĆļŗż.
RANTESļŖö ņĢäĒåĀĒö╝ Ēö╝ļČĆņŚ╝ ņŚ╝ņ”Øļ░śņØæ ņżæ ņāØņä▒ļÉśļŖö chemokineņ£╝ļĪ£ ĒśĖņé░ĻĄ¼ ļ░Å T ļ”╝ĒöäĻĄ¼ņØś ņØ┤ļÅÖĻ│╝ ĒÖ£ņä▒ņŚÉ Ļ┤ĆņŚ¼ĒĢśņŚ¼ ņŚ╝ņ”ØņØä ņ£ĀļÅäĒĢśļ®░, ņĢäĒåĀĒö╝ Ēö╝ļČĆņŚ╝ ĒÖśņ×ÉņŚÉņä£ ņ”ØĻ░ĆļÉśņ¢┤ ļéśĒāĆļé£ļŗż(Luster, 2002). HaCaT ņäĖĒżņŚÉņä£ ļ¬░ņĢĮņØś ĒĢŁņŚ╝ņ”Ø ļ░Å ĒĢŁņĢīļ¤¼ņ¦Ć ĒÜ©Ļ│╝ļź╝ ĒÖĢņØĖĒĢśĻĖ░ ņ£äĒĢśņŚ¼ RANTESņØś ļ░£ĒśäņØä mRNA ņłśņżĆņŚÉņä£ realtime RT-PCR ļ░śņØæņØä ĒåĄĒĢśņŚ¼ ņĖĪņĀĢĒĢśņśĆļŗż. ĻĘĖ Ļ▓░Ļ│╝ TNF-╬▒ ļ░Å IFN-╬│ ņ×ÉĻĘ╣ņ£╝ļĪ£ ņØĖĒĢśņŚ¼ RANTES ņāØņä▒ņØ┤ ņ£ĀņØśĒĢśĻ▓ī ņ”ØĻ░ĆĒĢśņśĆņ£╝ļéś, ļ¬░ņĢĮ ņĀä ņ▓śļ”¼ņŚÉ ņØśĒĢśņŚ¼ 0.1, 0.5 ļ░Å 1 mg/mL ļåŹļÅä ņØśņĪ┤ņĀüņ£╝ļĪ£ ņ£ĀņØśĒĢśĻ▓ī Ļ░ÉņåīĒĢśņśĆļŗż(Fig. 2). ļ¬░ņĢĮņØĆ HaCaT ņäĖĒżņŚÉņä£ ņĢäĒåĀĒö╝ Ēö╝ļČĆņŚ╝ Ļ┤ĆļĀ© ChemokineņØĖ RANTESļź╝ ĒÜ©Ļ│╝ņĀüņ£╝ļĪ£ Ļ░Éņåīņŗ£ņ╝░ļŗż. ņØ┤ Ļ▓░Ļ│╝ļŖö ļ¬░ņĢĮņØ┤ ņĢäĒåĀĒö╝ Ēö╝ļČĆņŚ╝ Ļ┤ĆļĀ© ChemokineņØĖ RANTESņØś ņ¢ĄņĀ£ļź╝ ĒåĄĒĢśņŚ¼ ņĢäĒåĀĒö╝ Ēö╝ļČĆņŚ╝ ņŚ╝ņ”Øļ░śņØæ ņ£ĀļÅäņŚÉ Ļ┤ĆņŚ¼ĒĢśļŖö Tļ”╝ĒöäĻĄ¼ņÖĆ ņŚ╝ņ”Øņä▒ ņäĖĒżņØś ņØ┤ļÅÖĻ│╝ ĒÖ£ņä▒ņØä ņĪ░ņĀłĒĢ©ņ£╝ļĪ£ņŹ© ņŚ╝ņ”ØņäĖĒżņØś ņ╣©ņ£żņØä ņ¢ĄņĀ£ĒĢśņŚ¼ Ēö╝ļČĆ Ļ░üņ¦łĒśĢņä▒ņäĖĒżļź╝ ļ│┤ĒśĖĒĢĀ ņłś ņ׳ņØīņØä ļ│┤ņŚ¼ņżĆļŗż. ņĢäĒåĀĒö╝ Ēö╝ļČĆņŚ╝ ņŚ╝ņ”Øļ░śņØæ ņŗ£ RANTESņØś ļ░£Ēśä ņ¢ĄņĀ£ļŖö ņŚ╝ņ”Øņä▒ ņäĖĒżļōżņØś ņ╣©ņ£żņ£╝ļĪ£ļČĆĒä░ Ēö╝ļČĆļź╝ ļ│┤ĒśĖĒĢśĻ│Ā, ņŚ╝ņ”Øļ░śņØæņ£╝ļĪ£ ņØĖĒĢ£ ņåÉņāüņØä ņ¢ĄņĀ£ĒĢĀ ņłś ņ׳ļŗż. ļ¬░ņĢĮņØĆ ņŗØļ¼╝ņä▒ņŖżĒģīļĪ£ņØ┤ļō£(phytosteroids)ļĪ£ņä£ ņŗØļ¼╝ņāØļ”¼ĒÖ£ņä▒ļ¼╝ņ¦ł(Phytochemical)ļĪ£ ļ│┤Ļ│ĀļÉśņ¢┤ ņ׳ņ£╝ļ®░, ņŗØļ¼╝ņä▒ņŖżĒģīļĪ£ņØ┤ļō£ļŖö ņŖżĒģīļĪ£ņØ┤ļō£ņÖĆ ĻĄ¼ņĪ░ņĀüņ£╝ļĪ£ ņ£Āņé¼ĒĢśņŚ¼ ņŚ╝ņ”ØĻ│╝ņĀĢņØä ņĢłņĀĢņŗ£ĒéżļŖöļŹ░ ņżæņÜöĒĢ£ ņŚŁĒĢĀņØä ĒĢ£ļŗż. ņØ┤ļŖö ĻĖ░ņĪ┤ņŚÉ ļ│┤Ļ│ĀļÉ£ ļ¬░ņĢĮņØś ņāØļ”¼ ĒÖ£ņä▒ ļŖźļĀźņØ┤ Ēö╝ļČĆ Ļ░üņ¦łĒśĢņä▒ņäĖĒżņØś ņĢäĒåĀĒö╝ Ēö╝ļČĆņŚ╝ ņŚ╝ņ”Øļ░śņØæņŚÉņä£ļÅä ĒÜ©Ļ│╝Ļ░Ć ņ׳ņØīņØä ņØśļ»ĖĒĢ£ļŗż.
ņĢäĒåĀĒö╝ Ēö╝ļČĆņŚ╝ņŚÉņä£ ļīĆĒæ£ņĀüņ£╝ļĪ£ ļ░£ĒśäĒĢśļŖö Th2 chemokineņØĖ TARCļŖö ļ░Å MDCļŖö CCņ╝Ćļ¬©ņ╣┤ņØĖ ņłśņÜ®ņ▓┤ ņ£ĀĒśĢ 4(C-C chemokine receptor type 4, CCR4)ļź╝ Ļ▓Įņ£ĀĒĢśņŚ¼ ņŚ╝ņ”ØļČĆņ£äļĪ£ Th2 ļ”╝ĒöäĻĄ¼ņØś ņØ┤ļÅÖĻ│╝ ņ╣©ņ£żņØä ņ£ĀļÅäĒĢśņŚ¼ ņĢäĒåĀĒö╝ Ēö╝ļČĆņŚ╝ņŚÉ Ļ┤ĆņŚ¼ĒĢ£ļŗż(Rozyk et al., 2005). HaCaT ņäĖĒżņŚÉņä£ ļ¬░ņĢĮņØś ĒĢŁņŚ╝ņ”Ø ļ░Å ĒĢŁņĢīļ¤¼ņ¦Ć ĒÜ©Ļ│╝ļź╝ ĒÖĢņØĖĒĢśĻĖ░ ņ£äĒĢśņŚ¼ TARC ļ░Å MDCņØś ļ░£ĒśäņØä mRNA ņłśņżĆņŚÉņä£ realtime RT-PCR ļ░śņØæņØä ĒåĄĒĢśņŚ¼ ņĖĪņĀĢĒĢśņśĆļŗż. ĻĘĖ Ļ▓░Ļ│╝ TNF-╬▒ ļ░Å IFN-╬│ ņ×ÉĻĘ╣ņ£╝ļĪ£ ņØĖĒĢśņŚ¼ TARC ļ░Å MDCņØś ņāØņä▒ņØ┤ ņ£ĀņØśĒĢśĻ▓ī ņ”ØĻ░ĆĒĢśņśĆņ£╝ļéś, TARC ļ░Å MDC ļ¬©ļæÉņŚÉņä£ ļ¬░ņĢĮ ņĀä ņ▓śļ”¼ņŚÉ ņØśĒĢśņŚ¼ 0.1, 0.5 ļ░Å 1 mg/mL ļåŹļÅä ņØśņĪ┤ņĀüņ£╝ļĪ£ ņ£ĀņØśĒĢśĻ▓ī Ļ░ÉņåīĒĢśņśĆļŗż(Fig. 3). ļ¬░ņĢĮņØĆ HaCaT ņäĖĒżņŚÉņä£ ņĢäĒåĀĒö╝ Ēö╝ļČĆņŚ╝ Ļ┤ĆļĀ© ChemokineņØĖ TARC ļ░Å MDCļź╝ ĒÜ©Ļ│╝ņĀüņ£╝ļĪ£ Ļ░Éņåīņŗ£ņ╝░ļŗż. ņØ┤ Ļ▓░Ļ│╝ļŖö ļ¬░ņĢĮņØ┤ ņĢäĒåĀĒö╝ Ēö╝ļČĆņŚ╝ Ļ┤ĆļĀ© ChemokineņØĖ TARC ļ░Å MDC ņ¢ĄņĀ£ļź╝ ĒåĄĒĢśņŚ¼ Th2 ļ”╝ĒöäĻĄ¼ņØś ņØ┤ļÅÖĻ│╝ ņ╣©ņ£żņØä ņĀ£ĒĢ£ĒĢśņŚ¼ Ēö╝ļČĆ Ļ░üņ¦łĒśĢņä▒ ņäĖĒżļź╝ ļ│┤ĒśĖĒĢĀ ņłś ņ׳ņØīņØä ļ│┤ņŚ¼ņżĆļŗż. ņĢäĒåĀĒö╝ Ēö╝ļČĆņŚ╝ ĒÖśņ×ÉņØś Ēśłņ▓ŁņŚÉņä£ļŖö TARC ļ░Å MDCņØś ļ░£ĒśäņØ┤ ņ”ØĻ░ĆļÉśņ¢┤ ļéśĒāĆļéśļŖö Ļ▓āņ£╝ļĪ£ ļ│┤Ļ│ĀļÉśĻ│Ā ņ׳ņ£╝ļ®░(Campbell et al., 1999; Song et al., 2006), ļ¦ÄņØĆ ņŚ░ĻĄ¼ņŚÉņä£ TARCņÖĆ MDCĻ░Ć ņĢäĒåĀĒö╝ Ēö╝ļČĆņŚ╝ ļ│æņØĖņŚÉ ņŻ╝ņÜöĒĢ£ ņŚŁĒĢĀņØä ĒĢśĻ│Ā ņ׳ņ£╝ļ®░, HaCaT ņäĖĒżņŚÉņä£ TARCņÖĆ MDCņØś ņāØņé░ Ļ░ÉņåīļŖö ņĢäĒåĀĒö╝ Ēö╝ļČĆņŚ╝ ņ╣śļŻīņØś ĒÜ©Ļ│╝ņĀüņØĖ Ēæ£ņĀüņØ┤ ļÉĀ ņłś ņ׳ļŗżĻ│Ā ļ│┤Ļ│ĀĒĢśņśĆļŗż(Nakazato et al., 2008; Qi et al., 2009). ļö░ļØ╝ņä£ TARCņÖĆ MDCņØś ņ¢ĄņĀ£ļŖö ņĢäĒåĀĒö╝ Ēö╝ļČĆņŚ╝ ņŚ╝ņ”Øļ░śņØæņŚÉņä£ Th2 ļ”╝ĒöäĻĄ¼ļĪ£ ņØĖĒĢ£ Ēö╝ļČĆ ņåÉņāüņØä ņ¢ĄņĀ£ĒĢśĻ│Ā Ēö╝ļČĆļź╝ ļ│┤ĒśĖĒĢĀ ņłś ņ׳ņØīņØä ļ│┤ņŚ¼ņżĆļŗż. ņØ┤ļŖö ĻĖ░ņĪ┤ņØś ļ¬░ņĢĮņØś ņāØļ”¼ ĒÖ£ņä▒ ļŖźļĀźņØ┤ Ēö╝ļČĆ Ļ░üņ¦łĒśĢņä▒ņäĖĒżņØś ņĢäĒåĀĒö╝ Ēö╝ļČĆņŚ╝ ņŚ╝ņ”Øļ░śņØæņŚÉņä£ļÅä ĒÜ©Ļ│╝Ļ░Ć ņ׳ņØīņØä ņØśļ»ĖĒĢ£ļŗż. ļ¬░ņĢĮņØĆ ņŗØļ¼╝ņä▒ņŖżĒģīļĪ£ņØ┤ļō£ļĪ£ņä£ ņŗØļ¼╝ņāØļ”¼ĒÖ£ņä▒ļ¼╝ņ¦łļĪ£ ļ│┤Ļ│ĀļÉśņ¢┤ ņ׳ļŗż. ĒśäļīĆ ņØśĒĢÖņŚÉņä£ ņŖżĒģīļĪ£ņØ┤ļō£ļŖö ļ®┤ņŚŁ ņĪ░ņĀł, Ļ░ä ļ│┤ĒśĖ, ĒĢŁņĢö, ĒĢŁĻĘĀ, ĒĢŁņ¦äĻĘĀ, ĒĢŁņŚ╝ ļ░Å ņŗ¼ņן Ļ░ĢĒÖö ĒÖ£ņä▒ņØä ĒżĒĢ©ĒĢ£ Ļ┤æļ▓öņ£äĒĢ£ ņĢĮļ”¼ĒĢÖņĀü ĒŖ╣ņä▒ņ£╝ļĪ£ ņØĖĒĢ┤ ņĢĮļ¼╝ ļ░£Ļ▓¼ ĒöäļĪ£ĻĘĖļשņŚÉ ĒżĻ┤äņĀüņ£╝ļĪ£ ņĀüņÜ® ļÉśļ®░, ļźśļ¦łĒŗ░ņŖż Ļ┤ĆņĀłņŚ╝(RA), ļŗżļ░£ņä▒ Ļ▓ĮĒÖöņ”Ø(MS), ņŗ¼ĒśłĻ┤Ć ņ¦łĒÖś, ņŚ╝ņ”Øņä▒ ņן ņ¦łĒÖś(IBD), Ļ│ĀņĮ£ļĀłņŖżĒģīļĪżĒśłņ”Ø, Ēü¼ļĪĀļ│æ ļ░Å ņĀ£1ĒśĢ ļŗ╣ļć©ļ│æĻ│╝ Ļ░ÖņØĆ ļŗżņ¢æĒĢ£ ņŚ╝ņ”Ø ņāüĒā£ņØś ņ╣śļŻīņŚÉļÅä ņé¼ņÜ®ļÉ£ļŗż(Ripa et al., 2018). ĒŖ╣Ē׳ ņŚ╝ņ”Ø ļ░śņØæ ļ░Å ņĢīļĀłļź┤ĻĖ░ ļ│æņøÉņ▓┤ ļ░Å ņ×ÉĻ░Ćļ®┤ņŚŁ ņ¦łĒÖśņØś ņ┤łĻĖ░ ņāüĒā£ļź╝ ņ¢ĄņĀ£ĒĢśļŖöļŹ░ ĒÜ©Ļ│╝ņĀüņ£╝ļĪ£ ņé¼ņÜ®ļÉśļŖö ĻĖĆļŻ©ņĮöņĮöļź┤Ēŗ░ņĮöņØ┤ļō£ļŖö ņןĻĖ░ņĀüņ£╝ļĪ£ ļ¬ć Ļ░Ćņ¦Ć ņŗ¼Ļ░üĒĢ£ ņØśĒĢÖņĀü ĒĢ®ļ│æņ”ØņØä Ļ░Ćņ¦ĆĻ│Ā ņ׳ņ¢┤, ĻĖĆļŻ©ņĮöņĮöļź┤Ēŗ░ņĮöņØ┤ļō£ņÖĆ ĻĄ¼ņĪ░ņĀüņ£╝ļĪ£ ņ£Āņé¼ĒĢ£ ņŚ¼ļ¤¼ ņŗØļ¼╝ņä▒ņŖżĒģīļĪ£ņØ┤ļō£ļź╝ ņé¼ņÜ®ĒĢ£ ņŚ╝ņ”Øņä▒ ņ¦łĒÖś ņ╣śļŻīĻ░Ć ļŗżņ¢æĒĢśĻ▓ī ļ│┤Ļ│ĀļÉśĻ│Ā ņ׳ļŗż. ĻĖĆļŻ©ņĮöņĮöļź┤Ēŗ░ņĮöņØ┤ļō£ ļīĆņ▓┤ Ļ░ĆļŖźĒĢ£ ņŗØļ¼╝ņä▒ņŖżĒģīļĪ£ņØ┤ļō£ļŖö withaferin A, stigmasterol, ╬▓-sitosterol, guggulsterone, diosgenin, sarsasapogenin, physalin A, Dioscinņ£╝ļĪ£ ĻĖ░ņĪ┤ ņ╣śļŻīņŚÉ ļīĆĒĢ£ ļ│┤ņĪ░ņĀ£ļĪ£ ņé¼ņÜ®ļÉśĻ▒░ļéś ņŗżņĀ£ļĪ£ ņĢĮļ¼╝ņØä ļīĆņ▓┤ĒĢśļŖö ļŹ░ ņé¼ņÜ®ĒĢĀ ņłś ņ׳ļŗż(Rishab et al., 2021). ņØ┤ņżæ ╬▓-sitosterolĻ│╝ guggulsteroneņØĆ ļ¬░ņĢĮņØś ņŻ╝ņÜö ņä▒ļČäņ£╝ļĪ£ ļ│┤Ļ│ĀļÉśņ¢┤ ņ׳ļŗż. ╬▓-sitosterolņØĆ ņäĖĒż ņä▒ņןĻ│╝ Ļ░üņ¦łņäĖĒż ļ░Å ļīĆņŗØņäĖĒżļĪ£ļČĆĒä░ņØś ņŚ╝ņ”Ø ņØĖņ×ÉņØś ļČäļ╣äļź╝ ņ¢ĄņĀ£ĒĢśļŖö ĒĢŁņŚ╝ņ”Ø ņ×æņÜ®ņŚÉ ļīĆĒĢśņŚ¼ Ļ┤æļ▓öņ£äĒĢśĻ▓ī ņŚ░ĻĄ¼ļÉśņ¢┤ ņ׳ņ£╝ļ®░, guggulsteroneņØĆ RA, Ļ│Āņ¦ĆĒśłņ”Ø, Ļ░äņ¦ł ļ░Å ļ╣äļ¦īĻ│╝ Ļ░ÖņØĆ ļŗżņ¢æĒĢ£ ņןņĢĀļź╝ ņ╣śļŻīĒĢśĻĖ░ ņ£äĒĢ┤ ņĢäņ£Āļź┤ļ▓Āļŗż ņØśĒĢÖņŚÉņä£ ļäÉļ”¼ ņé¼ņÜ®ļÉśļŖö ļ¬░ņĢĮņØś ĒÖ£ņä▒ ĒÖöĒĢ®ļ¼╝ņØ┤ļŗż(Nagarajan et al., 2001). ļśÉĒĢ£ ļ¼ĖĒŚī ņĪ░ņé¼ņŚÉ ļö░ļź┤ļ®┤, guggulsteroneņØĆ Ļ░ĢļĀźĒĢ£ ĒĢŁņŚ╝ņ”ØņĀ£ļĪ£ ļ░£Ļ▓¼ļÉśņŚłņ£╝ļ®░ ņŚ╝ņ”Ø ļ░Å ņĢīļĀłļź┤ĻĖ░ ņ¦łĒÖśņŚÉ ļīĆĒĢ£ ņÜ®ļÅäļź╝ ņ×ģņ”ØĒĢĀ ņŚ░ĻĄ¼Ļ░Ć ņ¦ĆņåŹņĀüņ£╝ļĪ£ ļ│┤Ļ│ĀļÉśĻ│Ā ņ׳ļŗż(Rishab et al., 2021). ļ¬░ņĢĮĻ│╝ Ļ░ÖņØĆ ņŗØļ¼╝ ĻĖ░ļ░ś ļ¼╝ņ¦łņŚÉņä£ ĒīīņāØļÉ£ ņØśņĢĮ ņĀ£ņĀ£ļŖö ņĄ£ņåīĒĢ£ņØś ņĀäņŗĀ ļÅģņä▒ ņŚåņØ┤ ņŚ╝ņ”Ø, ņĢīļĀłļź┤ĻĖ░ ņāüĒā£ ļ░Å Ļ┤ĆļĀ© ĒĢ®ļ│æņ”ØņØä ņ╣śļŻīĒĢĀ ņłś ņ׳ļŖö ņ×Āņ×¼ņĀüņØĖ ļīĆņĢłņØ┤ ļÉĀ ņłś ņ׳ļŗż.
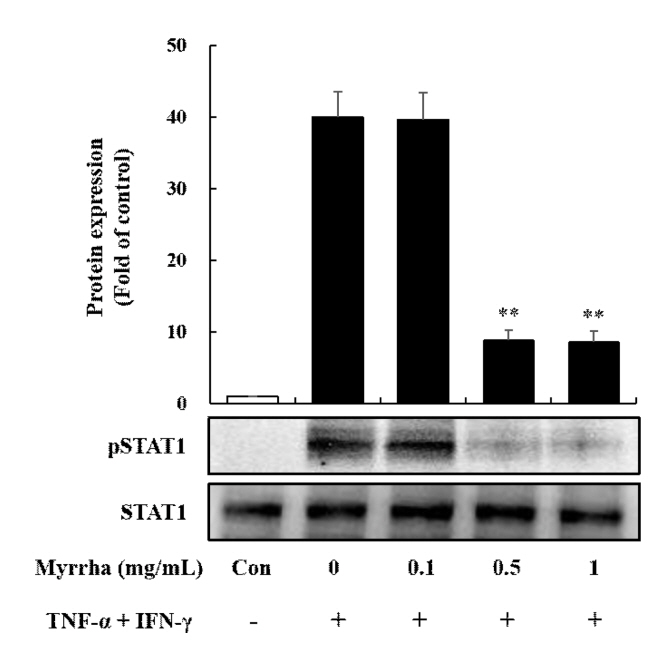
STAT1 ņŗĀĒśĖ ņĀäļŗ¼ ĻĖ░ņĀäņØĆ TNF-╬▒ ļ░Å IFN-╬│ņÖĆ Ļ░ÖņØĆ ļŗżņ¢æĒĢ£ ņŚ╝ņ”Ø ņ×ÉĻĘ╣ņŚÉ ņØśĒĢśņŚ¼ ĒÖ£ņä▒ĒÖöļÉśļŖö ņżæņÜöĒĢ£ ņĀäņé¼ ļČäņ×ÉņØ┤ļŗż. JAK/STAT ņŗĀĒśĖ ņĀäļŗ¼ ĻĖ░ņĀäņØś ĒÖ£ņä▒ĒÖöļŖö TNF-╬▒ ļ░Å IFN-╬│ļĪ£ ļ¦żĻ░£ ļÉ£ HaCaT ņäĖĒżņŚÉņä£ Chemokine ļ░Å CytokineņØś ņāØņä▒ņØä ņ£ĀļÅäĒĢ£ļŗż(Ju et al., 2009). ļśÉĒĢ£, RANTESņÖĆ MDCņØś ņ┤ēņ¦äņ£ĀņĀäņ×ÉļŖö STAT ļ░Å NF-╬║B Ļ▓░ĒĢ® ļČĆņ£äļź╝ ĒżĒĢ©ĒĢśĻĖ░ ļĢīļ¼ĖņŚÉ, ChemokineņØś ņāØņä▒ņØĆ STAT1 ļ░Å NF-╬║B Ļ▓ĮļĪ£ņØś ĒÖ£ņä▒ĒÖöļź╝ ĒåĄĒĢśņŚ¼ ņĪ░ņĀłļÉĀ ņłś ņ׳ļŗż(Kovacic et al., 2010; Nakayama et al., 2004). ļö░ļØ╝ņä£ HaCaT ņäĖĒżņŚÉ ļ¬░ņĢĮ ņĀä ņ▓śļ”¼Ļ░Ć TNF-╬▒ ļ░Å IFN-╬│ ņ×ÉĻĘ╣ņ£╝ļĪ£ STAT1 ņŗĀĒśĖ ņĀäļŗ¼ ĻĖ░ņĀäņØś ņØĖņé░ĒÖö(Phosphorylation)ņŚÉ ņśüĒ¢źņØä ļ»Ėņ╣śļŖöņ¦Ć ņĪ░ņé¼ĒĢśņśĆļŗż. ĻĘĖ Ļ▓░Ļ│╝ TNF-╬▒ ļ░Å IFN-╬│ņØś ņ×ÉĻĘ╣ņ£╝ļĪ£ ņØĖĒĢśņŚ¼ Phospho-STAT1 ņŗĀĒśĖ ņĀäļŗ¼ ĻĖ░ņĀäņØ┤ ņ”ØĻ░ĆļÉ£ Ļ▓āņØä ĒÖĢņØĖĒĢĀ ņłś ņ׳ņŚłņ£╝ļ®░, ļ¬░ņĢĮ 0.5 ļ░Å 1 mg/mL ņĀä ņ▓śļ”¼ņŗ£ Phospho-STAT1ņØ┤ ņ£ĀņØśĒĢśĻ▓ī Ļ░ÉņåīĒĢśņśĆļŗż(Fig. 4). ņØ┤ņāüņØś ņŗżĒŚśĻ▓░Ļ│╝ļŖö TNF-╬▒ ļ░Å IFN-╬│ ņ×ÉĻĘ╣ņŚÉ ņØśĒĢ£ ļ¬░ņĢĮņØś Chemokine ņāØņä▒ ņ¢ĄņĀ£Ļ░Ć STAT1 ņŗĀĒśĖ ņĀäļŗ¼ ĻĖ░ņĀäņØś PhosphorylationņØä ņ¢ĄņĀ£ĒĢ©ņ£╝ļĪ£ņä£ ļ¦żĻ░£ļÉśļŖö Ļ▓āņ£╝ļĪ£ ĒÖĢņØĖļÉśņŚłļŗż. ņØ┤ļ¤¼ĒĢ£ Ļ▓░Ļ│╝ļŖö ļ¬░ņĢĮņØ┤ ņĢäĒåĀĒö╝ Ēö╝ļČĆņŚ╝Ļ│╝ Ļ░ÖņØĆ ņŚ╝ņ”Øņä▒ Ēö╝ļČĆ ņ¦łĒÖśņØś ņ×Āņ×¼ņĀü ņ╣śļŻīņĀ£ļĪ£ņä£ ņ×äņāüņĀüņ£╝ļĪ£ ņé¼ņÜ®ļÉĀ ņłś ņ׳ņØä Ļ▓āņ£╝ļĪ£ ņé¼ļŻīļÉ£ļŗż.
ļ│Ė ņŚ░ĻĄ¼ņŚÉņä£ļŖö ļ¬░ņĢĮņØś ņĢäĒåĀĒö╝ Ēö╝ļČĆņŚ╝ ņŚ╝ņ”Øļ░śņØæ Ļ┤ĆļĀ© ChemokineņØś ņāØņä▒ ņ¢ĄņĀ£ ĒÜ©Ļ│╝ņÖĆ ĻĘĖ ĻĖ░ņĀäņŚÉ ļīĆĒĢśņŚ¼ ĒÖĢņØĖĒĢśņśĆņ£╝ļ®░, ļŗżņØīĻ│╝ Ļ░ÖņØĆ Ļ▓░ļĪĀņØä ņ¢╗ņŚłļŗż. ļ¬░ņĢĮ ņČöņČ£ļ¼╝ņØĆ HaCaT ņäĖĒżņŚÉņä£ TNF-╬▒ ļ░Å IFN-╬│ļĪ£ ņ×ÉĻĘ╣ĒĢ£ Ēøä ņĢäĒåĀĒö╝ Ēö╝ļČĆņŚ╝ Ļ┤ĆļĀ© ChemokineņØĖ RANTES, TARC ļ░Å MDCņØś ņāØņä▒ņØä mRNA ņłśņżĆņŚÉņä£ ĒÖĢņØĖĒĢ£ Ļ▓░Ļ│╝, RANTES, TARC ļ░Å MDCņØś ļ░£ĒśäņØ┤ ļ¬░ņĢĮ ļåŹļÅä ņØśņĪ┤ņĀüņ£╝ļĪ£ ņ£ĀņØśĒĢśĻ▓ī Ļ░ÉņåīĒĢśņśĆņ£╝ļ®░, ļ¬░ņĢĮ 1 mg/mL ļåŹļÅäņŚÉņä£ Ļ░Ćņן ņ£ĀņØśĒĢ£ Ļ░Éņåīļź╝ ļ│┤ņśĆļŗż. ņØ┤ļ¤¼ĒĢ£ ļ¬░ņĢĮņØś ņĢäĒåĀĒö╝ Ēö╝ļČĆņŚ╝ Ļ┤ĆļĀ© ChemokineņØś ņāØņä▒ ņ¢ĄņĀ£ ĒÜ©Ļ│╝ļŖö STAT1 ņŗĀĒśĖ ņĀäļŗ¼ ĻĖ░ņĀä Phosphorylation ņ¢ĄņĀ£ļź╝ ĒåĄĒĢśņŚ¼ ļéśĒāĆļé£ Ļ▓āņØä ĒÖĢņØĖĒĢśņśĆļŗż. ļö░ļØ╝ņä£ ļ¬░ņĢĮņØĆ Ēö╝ļČĆļ»ĖņÜ® ņĀ£ĒÆł Ļ░£ļ░£ņØś ņ▓£ņŚ░ļ¼╝ ņøÉļŻīļĪ£ņä£ ĒÖöņןĒÆł ņåīņ×¼ ļ░Å ņĢäĒåĀĒö╝ Ēö╝ļČĆņŚ╝ ņŚ╝ņ”Ø ņÖäĒÖö ņåīņ×¼ļĪ£ņä£ ĒÖ£ņÜ®ņØ┤ Ļ░ĆļŖźĒĢĀ Ļ▓āņ£╝ļĪ£ ņśłņāüļÉ£ļŗż. ļśÉĒĢ£, ņČöĒøä ņŚ░ĻĄ¼ļź╝ ĒåĄĒĢśņŚ¼ ņĢäĒåĀĒö╝ Ēö╝ļČĆņŚ╝ in vivo ļ¬©ļŹĖņŚÉņä£ ļ¬░ņĢĮņØś Chemokine RANTES, TARC ļ░Å MDCņØś ņāØņä▒ņØś ņ¢ĄņĀ£ ĒÜ©Ļ│╝ Ļ▓Ćņ”ØĻ│╝ ļŗżņ¢æĒĢ£ ņŚ╝ņ”Ø ņ¦ĆĒæ£ņØś ļ░£ĒśäņŚÉ ļīĆĒĢ£ ņ£ĀĒÜ©ņä▒ ņŚ░ĻĄ¼ ļ░Å ĻĖ░ņĀäņŚ░ĻĄ¼ļÅä ņČöĻ░ĆņĀüņ£╝ļĪ£ ņ¦äĒ¢ēļÉśņ¢┤ņĢ╝ ĒĢĀ Ļ▓āņ£╝ļĪ£ ņé¼ļŻīļÉ£ļŗż.
Fig.┬Ā1.
Cytotoxic Effects of Myrrha in HaCaT cells. The cell viability was measured by MTT assay. HaCaT cells were incubated with or without Myrrha, Myrrha as indicated doses (0.01, 0.05, 0.1, 0.25, 0.5, 0.75, 1, 2, 5, 10 or 50 mg/mL) for 24 h. **p < 0.01 vs control. The values are means ┬▒ S.D. of three independent experiments.
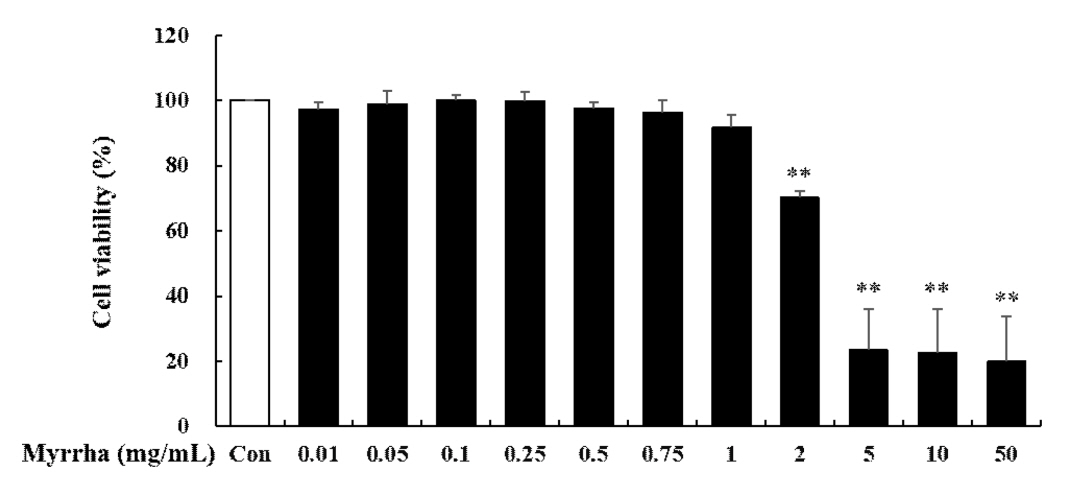
Fig.┬Ā2.
Effects of Myrrha on mRNA expression of RANTES chemokine in HaCaT cells. HaCaT cells were pre-treated with Myrrha (0.1, 0.5 or 1 mg/mL) for 1 h and incubation with TNF-╬▒ and IFN-╬│ (10 ng/mL) for 24 h. The mRNA levels of RANTES were measured by real-time RT-PCR. *p < 0.05 and **p < 0.01 vs TNF-╬▒ + IFN-╬│ alone. The values are means ┬▒ S.D. of three independent experiments.
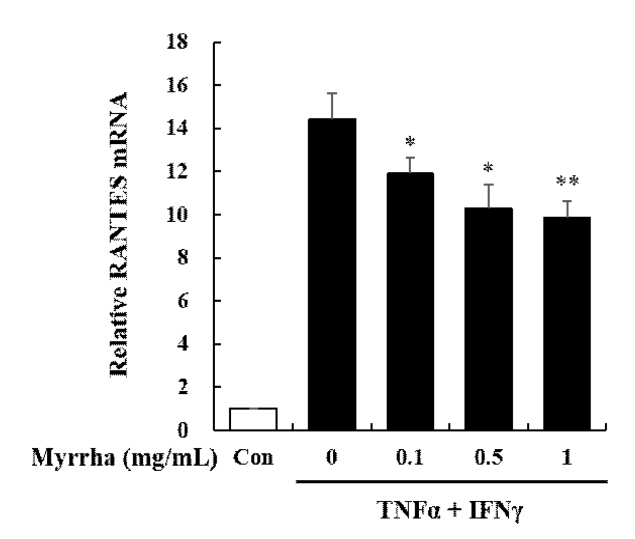
Fig.┬Ā3.
Effects of Myrrha on mRNA expression of TARC and MDC chemokines in HaCaT cells. HaCaT cells were pre-treated with Myrrha (0.1, 0.5 or 1 mg/mL) for 1 h and incubation with TNF-╬▒ and IFN-╬│ (10 ng/mL) for 24 h. The mRNA levels of (A) TARC (B) MDC were measured by real-time RT-PCR. *p < 0.05 and **p < 0.01 vs TNF-╬▒ + IFN-╬│ alone. The values are means ┬▒ S.D. of three independent experiments.

Fig.┬Ā4.
Effects of Myrrha on TNF-╬▒ and IFN-╬│ induced STAT1 Phosphorylation in HaCaT cells. HaCaT cells were pre-treated with Myrrha (0.1, 0.5 or 1 mg/mL) for 1 h and incubation with TNF-╬▒ and IFN-╬│ (10 ng/mL) for 15 min. Phosphorylated and total expression of STAT1 were detected by Western blot analysis using specific antibodies. The similar results were obtained from three additional experiments. **p < 0.01 vs TNF-╬▒ + IFN-╬│ alone. The values are means ┬▒ S.D. of three independent experiments.
Table┬Ā1.
Preparation of myrrha
| Day 0 | Day 1 | Day 2-7 | Day 8 |
|---|---|---|---|
| Purchase and Preparation | Freezing | Freeze drying | Freeze-dried powder |
Table┬Ā2.
List of materials
Table┬Ā3.
Sequences of real-time RT-PCR primers
References
Ahn, C. J., Ahn, B. C., & Park, D. S. (1994). The analgesic effect of aqua-acupuncture with Corydalis Tuber, Olibanum Mastix & Myrrrha. Journal of Acupuncture Research, 11(1), 145-158.
Arellano, F. M., Wentworth, C. E., Arana, A., Fernandez, C., & Paul, C. F. (2007). Risk of lymphoma following exposure to calcineurin inhibitors and topical steroids in patients with atopic dermatitis. Journal of Investigative Dermatology, 127(4), 808-816, doi: 10.1038/sj.jid.5700622


Campbell, J. J., Haraldsen, G., Pan, J., Rottman, J., Qin, S., Ponath, P., Andrew, D. P., Warnke, R., Ruffing, N., Kassam, N., Wu, L., & Butcher, E. C. (1999). The chemokine receptor CCR4 in vascular recognition by cutaneous but not intestinal memory T cells. Nature, 400(6746), 776-780, doi: 10.1038/23495


Gang, I. G., Lee, S. C., & Son, S. H. (1991). Stuides on the clinical and microbiological effect of toothpaste containing theae folium, myrrha, mori radicis and cimicifugae rhizoma extract. Journal of Periodontal and Implant Science, 21(1), 173.
Han, J. S., Shin, D. H., & Baek, N. O. (2001). Identification of Growth Inhibitory Substance on Food-borne Microorganisms from Commiphora molmol Engl. and Its Application to Food Products. Korean Journal of Food Science and Technology, 33(4), 401-408.
Hanus, L. O., Rezanka, T., Dembitsky, V. M., & Moussaieff, A. (2005). Myrrh--Commiphora chemistry. Biomedical papers of the Medical Faculty of the University Palack├Į, Olomouc, Czechoslovakia, 149(1), 3-27, doi: 10.5507/bp.2005.001

Hough, L., Jones, J. K. N., & Wadman, W. H. (1952). Some observations on the Constitution of Gum Myrrh. Journal of the Chemical Society, 796-800, doi: 10.1039/JR9520000796
Kovacic, J. C., Gupta, R., Lee, A. C., Ma, M., Fang, F., Tolbert, C. N., Walts, A. D., Beltran, L. E., San, H., Chen, G., Hilaire, C. St., & Boehm, M. (2010). Stat3-dependent acute Rantes production in vascular smooth muscle cells modulates inflammation following arterial injury in mice. The Journal of Clinical Investigation, 120(1), 303-314, doi: 10.1172/JCI40364


Jang, Y. A., Cheon, S. J., Jang, M. J., Jun, D. H., Cho, W. A., Kwon, O. J., Kim, T. H., Kim, Y. H., & Lee, J. T. (2009). Anti-inflammatory and Cosmeceutical Activies of Commiphora molmol. Jounal of The Korean Society of Cosmetology, 15(3), 727-734.
Jeong, S. .I., Choi, B. M., & Jang, S. I. (2010). Sulforaphane suppresses TARC/CCL17 and MDC/CCL22 expression through heme oxygenase-1 and NF-kappaB in human keratinocytes. Archives of Pharmacal Research, 33(11), 1867-1876, doi: 10.1007/s12272-010-1120-6


Jo, I. J., & Choi, M. O. (2021). Protective Effects of Kyungohkgo on Atopic Dermatitis in HaCaT Cells. Jounal of The Korean Society of Cosmetology, 27(5), 1286-1292.

Ju, S. M., Song, H. Y., Lee, S. J., Seo, W. Y., Sin, D. H., Goh, A. R., Kang, Y. H., Kang, I. J., Won, M. H., Yi, J. S., Kwon, D. J., Bae, Y. S., Choi, S. Y., & Park, J. S. (2009). Suppression of thymus- and activation-regulated chemokine (TARC/CCL17) production by 1,2,3,4,6-penta-O-galloyl-beta-D-glucose via blockade of NF-kappaB and STAT1 activation in the HaCaT cells. Biochemical and Biophysical Research Communications, 387(1), 115-120, doi: 10.1016/j.bbrc.2009.06.137


Larsen, F. S., & Hanifin, J. M. (2002). Epidemiology of atopic dermatitis. Immunology and Allergy Clinics, 22(1), 1-24, doi: 10.1016/S0889-8561(03)00066-3

Lee, G. S., Jung, H. M., Oh, S. K., Cheong, J. H., & Kang, T. J. (2012). Effects of herbal complex on atopic dermatitis in BALB/c Mice. The Korean Society of Pharmacognosy, 43(1), 59-66.
Lee, J. S., Kim, I. S., Ryu, J. S., & Yun, C. Y. (2008). House dust mite, dermatophagoides pteronissinus increases expression of MCP-1, IL-6, and IL-8 in human monocytic THP-1 cells. Cytokine, 42(3), 365-371, doi: 10.1016/j.cyto.2008.03.010


Lee, S. H. (2010). Analysis of anti-allergic activities by chaff vinegar liquor. Journal of Life Science, 20(6), 960-963, doi: 10.5352/JLS.2010.20.6.960

Leung, D. Y., Boguniewicz, M., Howell, M. D., Nomura, I., & Hamid, Q. A. (2004). New insights into atopic dermatitis. Journal of Clinical Investigation, 113(5), 651-657, doi: 10.1172/JCI21060



Luster, A. D. (2002). The role of chemokines in linking innate and adaptive immunity. Current Opinion in Immunology, 14(1), 129-135, doi: 10.1016/s0952-7915(01)00308-9


Marahatha, R., Gyawali, K., Sharma, K., Gyawali, N., Tandan, P., Adhikari, A., Timilsina, G., Bhattarai, S., Lamichhane, G., Acharya, A., Pathak, I., Devkota, H. P., & Parajuli, N. (2021). Pharmacologic activities of phytosteroids in inflammatory diseases: Mechanism of action and therapeutic potentials. Phytotherapy Research, 35(9), 5103-5124, doi: 10.1002/ptr.7138


Nagarajan, M., Waszkuc, T. W., & Sun, J. (2001). Simultaneous determination of E- and Z-guggulsterones in dietary supplements containing Commiphora mukul extract (guggulipid) by liquid chromatography. Journal of AOAC International, 84(1), 24-28, doi: 10.1093/jaoac/84.1.24


Nakayama, T., Hieshima, K., Nagakubo, D., Sato, E., Nakayama, M., Kawa, K., & Yoshie, O. (2004). Selective induction of Th2-attracting chemokines CCL17 and CCL22 in human B cells by latent membrane protein 1 of Epstein-Barr virus. Journal of Virology, 78(4), 1665-1674, doi: 10.1128/jvi.78.4.1665-1674.2004



Nakazato, J., Kishida, M., Kuroiwa, R., Fujiwara, J., Shimoda, M., & Shinomiya, N. (2008). Serum levels of Th2 chemokines, CCL17, CCL22, and CCL27, were the important markers of severity in infantile atopic dermatitis. Pediatric Allergy and Immunology, 19(7), 605-613, doi: 10.1111/j.1399-3038.2007.00692.x


Nam, S. U., Lee, B. G., & Jo, H. G. (2003). Acceleration of Wound Healing on Scald Burn Skin Using Irradiation of TDP and Skin Spread of Myrrha. The Korea Journal of Herbology, 18(4), 263-268.
Park, J. K., Jo, O. H., Kim, S. B., & Cho, H. B. (2006). Myrrhainduced Apoptosis in Human Cervical Carcinoma HeLa Cells. The Journal of Korean Obstetrics and Gynecology, 19(1), 97-110.
Park, Y. L., & Park, J. (2007). Pathogenesis of atopic dermatitis. Korean Journal Investigative Dermatology, 14:67-72.
Pham, T. H., Kim, M. S., Le, M. Q., Song, Y. S., Bak, Y., Ryu, H. W., Oh, S. R., & Yoon, D. Y. (2017). Fargesin exerts antiinflammatory effects in THP-1 monocytes by suppressing PKCdependent AP-1 and Nf-╬║B signaling. Phytomedicine, 24:96-103, doi: 10.1016/j.phymed.2016.11.014


Qi, X. F., Kim, D. H., Yoon, Y. S., Li, J. H., Song, S. B., Jin, D., Huang, X. Z., Teng, Y. C., & Lee, K. J. (2009). The adenylyl cyclase-cAMP system suppresses TARC/CCL17 and MDC/CCL22 production through p38 MAPK and NF-kappaB in HaCaT keratinocytes. Molecular Immunology, 46(10), 1925-1934, doi: 10.1016/j.molimm.2009.03.018


Rozyk, K. J., Targowski, T., Paluchowska, E., Owczarek, W., & Kucharczyk, A. (2005). Serum thymus and activation-regulated chemokine, macrophage-derived chemokine and eotaxin as markers of severity of atopic dermatitis. Allergy, 60(5), 685-688, doi: 10.1111/j.1398-9995.2005.00774.x


Ripa, L., Edman, K., Dearman, M., Edenro, G., Hendrickx, R., Ullah, V., Chang, H. F., Lepist├Č, M., Chapman, D., Geschwindner, S., Wissler, Lisa., Svanberg, P., Lawitz, K., Malmberg, J., Nikitidis, A., Olsson, R. I., Bird, J., Llinas, A., Myrb├żck, T. H., Berger, M., Thorne, P., Harrison, R., K├Čhler, C., & Drmota, T. (2018). Discovery of a novel Oral glucocorticoid receptor modulator (AZD9567) with improved side effect profile. Journal of Medicinal Chemistry, 61(5), 1785-1799, doi: 10.1021/acs.jmedchem.7b01690


Searing, D. A., & Leung, D. Y. (2010). Vitamin D in atopic dermatitis, asthma and allergic diseases. Immunology and Allergy Clinics of North America, 30(3), 397-409, doi: 10.1016/j.iac.2010.05.005



Song, T. W., Sohn, M.H., Kim, E. S., Kim, K. W., & Kim, K. E. (2006). Increased serum thymus and activation-regulated chemokine and cutaneous T cell-attracting chemokine levels in children with atopic dermatitis. Clinical & Experimental Allergy, 36(3), 346-351.


Tanaka, K., Roberts, M. H., Yamamoto, N., Sugiura, H., Uehara, M., & Hopkin, J. M. (2006). Upregulating promoter polymorphisms of rantes relate to atopic dermatitis. International Journal of Immunogenetics, 33(6), 423-428, doi: 10.1111/j.1744-313X.2006.00635.x


Werfel, T. (2009). The role of leukocytes, keratinocytes, and allergenspecific IgE in the development of atopic dermatitis. Journal of Investigative Dermatology, 129(8), 1878-1891, doi: 10.1038/jid.2009.71


Yang, H. J., Park, K. W., Kim, H. S., Cho, S, M.., & Park, K. M. (2010). Effect of anti-atopic allergic reaction in response to oriental herb extracts. Korean Journal of Food Science and Technology, 42(1), 109-114.
Yang, J. H., Hwang, Y. H., Gu, M. J., Cho, W. K., & Ma, J. Y. (2015). Ethanol extracts of Sanguisorba officinalis L. Suppress TNF-alpha/IFN-gamma-induced pro-inflammatory chemokine production in HaCaT cells. Phytomedicine, 22(14), 1262-1268, doi: 10.1016/j.phymed.2015.09.006
Yu, S. H., Drucker, A. M., Lebwohl, M., & Silverberg, J. I. (2018). A systematic review of the safety and efficacy of systemic corticosteroids in atopic dermatitis. Journal of the American Academy of Dermatology, 78(4), 733-740, doi: 10.1016/j.jaad.2017.09.074


- TOOLS
-
METRICS

-
- 2 Crossref
- 0 Scopus
- 1,975 View
- 30 Download
- Related articles
-
Protective Effects of Kyungohkgo on Atopic Dermatitis in HaCaT Cells2021 October;27(5)



 PDF Links
PDF Links PubReader
PubReader ePub Link
ePub Link Full text via DOI
Full text via DOI Download Citation
Download Citation Print
Print